Es innegable que los procedimientos adhesivos revolucionaron la odontología, una vez que permitieron que las preparaciones cavitarias dejasen de ser retentivas y, en lugar de eso, se adhirieran a los tejidos, lo que a su vez implicó en un menor desgaste del remanente dental.
Sin embargo, vale la pena aclarar que diferentes sustratos, esmalte y dentina, requieren de protocolos de preparación distintos. La atención al tipo de sustrato y al sistema adhesivo a ser indicado es importante para alcanzar el éxito con la estrategia adhesiva escogida.
El esmalte posee aproximadamente 97% de contenido inorgánico, representado por cristales de fosfato de calcio bajo la forma de hidroxiapatita, con cantidades de carbonato, sodio, magnesio, cloruro, potasio y flúor, alrededor del 1% de material orgánico de naturaleza básicamente proteica, con escasos carbohidratos y lípidos y 2% de agua 1,2.
La preparación del esmalte para la adhesion se logra grabando con ácido fosofórico entre 30 y 40% por un período entre 15 y 60 segundos. Este procedimiento transforma una superficie lisa y pulida en irregular, aumentando la energía de la superficie; lo que favorece el mojado del adhesivo una vez que disminuye el ángulo de contacto del adhesivo con el esmalte (Figura 1). Como el ácido retira la capa superficial de esmalte alrededor de 10 micrómetros y crea una capa de porosidades de 5 a 50 micrómetros, la aplicación del adhesivo permite que él fluya y, por capilaridad, llene estos microporos siendo entonces polimerizado, lo que forma los prolongamientos adhesivos (tags) que resultan en una unión micromecánica 8-11.
Como fue mencionado, el esmalte presenta baja cantidad de agua, lo que favorece la penetración del adhesivo, que es hidrófobo y no requiere la aplicación de primer. Por tratarse de adhesión en esmalte, solo es indicada la aplicación de ácido fosfórico seguida del lavado y el secado y de la aplicación del adhesivo hidrófobo, es decir, aislado en un frasco sin primer.
Los estudios clínicos y de laboratorio muestran que la adhesión al esmalte es eficaz y de larga duración y la presencia de esmalte en los márgenes favorece la longevidad. Por lo tanto, es importante trabajar por la conservación del esmalte. Un consejo para evitar los márgenes pigmentados de las restauraciones es grabar con ácido y aplicar el adhesivo más allá de los márgenes de la restauración para evitar que queden márgenes sin grabar; lo que favorece la pigmentación marginal.
En el caso de la dentina, el desafío es mayor, ya que este sustrato tiene diferente contenido inorgánico y una mayor cantidad de materia orgánica y humedad, y está estrechamente relacionado con la pulpa, lo que dificulta obtener excelentes resultados de adhesión.

.png?width=600&name=2Scanning%20electron%20microscopy%20(SEM).png)
La dentina es un tejido mineralizado y avascular que contiene extensiones de odontoblastos que se encuentran dentro de los túbulos. Apróximadamente el 70% de su peso es mineral en forma de hidroxiapatita carbonatada, siendo el 18% restante material orgánico y aproximadamente 12% agua. La matriz orgánica es rica en colágeno, principalmente tipo I, y proteínas sin colágeno (Figura 2).
Su estructura es tubular, rellena de fluido dentinar bajo constante presión pulpar y con extensiones odontoblásticas en el interior. Los túbulos dentinarios se distribuyen siguiendo radialmente una curva en forma de S, de la pulpa al ADJ, y las fibrillas de colágeno están orientadas perpendicularmente a los túbulos dentinarios. El diámetro de los túbulos varía entre 0,8 y 3,0 μm entre el ADJ y la región cercana a la pulpa, respectivamente.
El número de túbulos dentinarios es, por lo tanto, mayor por área en la región pre-dental, cerca a la cámara pulpar, y más bajo por área en la unión amelo-dentinal.
Se calcula que hay aproximadamente 15.000/mm2 túbulos en la dentina periférica (cerca de la JAD), 25.000/mm2 en la región central y 55.000/mm2 cerca de la pulpa 13. Esto ocurre debido a la distribución radial de los túbulos, haciendo que exista esta mayor concentración tubular cerca de la pulpa. No se trata de una mayor cantidad absoluta de túbulos dentinarios. Por tanto, mientras más profunda sea la dentina, mayor será la cantidad de túbulos dentinarios por área y su diámetro; lo que significa que la dentina profunda es más permeable y húmeda y esto repercute directamente en el nivel de dificultad en nuestros procedimientos adhesivos tanto como en los tratamientos para el mantenimiento de la vitalidad pulpar 14. En realidad, diversos factores modifican este procedimiento, como la composición de la dentina, la edad del paciente, la exposición al ambiente de la cavidad bucal, la presencia de lesión cariosa y no cariosa 15 y el espesor de la dentina residual en esta cavidad.
Durante la preparación cavitaria, se forma una capa de residuos orgánicos e inorgánicos llamada barro dentinario (o smear layer) que presenta una baja resistencia de unión a la dentina, alrededor de 5 Mpa.
Esta capa destruye los túbulos, lo que reduce la permeabilidad alrededor del 86%. En la preparación de la dentina para adhesión pueden ser usadas diferentes estrategias adhesivas, siendo ellas el grabado total o autograbado.
La remoción completa del barro dentinario por el ácido y la consecuente desmineralización de la superficie de la dentina, exponiendo una fina tela de fibras colágenas para ser infiltrada por monómeros hidrófilos, es designada técnica “grabe y lave” (etchandrinse) (Figura 3). Siendo así, en la estrategia “grabe y lave”, la adhesión a la dentina cuenta principalmente con la penetración de monómeros adhesivos en la red de fibrillas colágenas expuestas por el ácido de grabado después de la remoción de la hidroxiapatita 16,17.
La dentina puede ser desmineralizada hasta una profundidad de cerca de 5 5 μm16, dependiendo del tipo de ácido, de la concentración y de la duración de la aplicación. El tiempo de grabado indicado en dentina es de 15 segundos pues hay evidencias 18 de que resultan en la disolución del mineral de los cristales envolviendo las fibras de colágeno, sin dañar la ultraestructura del colágeno.
El grabado con ácido de la dentina disminuye la energía de la superficie, por lo cual es necesaria la utilización de un primer hidrófilo previamente a la aplicación del adhesivo para favorecer su infiltración.
El primer es una solución de bajo peso molecular con un extremo hidrófilo que tiene afinidad con la dentina desmineralizada y otro hidrófobo capaz de co-polimerizar con adhesivo y solventes orgánicos.
Su aplicación debe ser hecha de forma activa (restregando) para que los solventes desplacen el agua de la superficie de la dentina y del interior de la red de fibrilas colágenas y puedan llevar los monómeros hidrófilos a través de la dentina, aumentando la energía de la superficie 11. El adhesivo hidrófobo debe ser aplicado enseguida para ocupar las irregularidades y microporosidades en el esmalte e infiltrarse por capilaridad en la dentina grabada, formando así, lo que llamamos capa híbrida.
 3. Técnica "grabe y lave" con ácido fosfórico Ultra-Etch al 35% (Ultradent).
3. Técnica "grabe y lave" con ácido fosfórico Ultra-Etch al 35% (Ultradent). 3A. Grabado de esmalte. 3B. Grabado de dentina.
3C. Apariencia después de enjuagar la cavidad.
.png?width=339&name=4.%20Selective%20enamel%20etching%20with%2035%25%20phosphoric%20acid%20Ultra-Etch%20(Ultradent).png)
En los casos de la estrategia “grabe y lave” de 2 pasos en que hay una solución de primer/adhesivo en frasco único, es indicada la aplicación activa (restregando) por 15 a 20 segundos, seguida de una nueva aplicación de la misma solución, como si la primera capa actuase como primer y la segunda como adhesivo, antes de la polimerización.
En adhesivos cuyo solvente es la acetona, es indicada la aplicación de más capas. La estrategia de auto-grabado (selfetch) modifica el barro dentinario, incorporándolo a la capa adhesiva. En este caso no se aplica ácido fosfórico en la dentina sino un primer ácido que crea una interacción menos agresiva con la dentina y permite la preservación de la hidroxiapatita interfibrilar y los enlaces químicos que allí ocurren.
Esta estrategia es menos susceptible al operador, una vez que elimina el paso de control de la humedad post-grabado. La aplicación de este primer ácido también debe ser hecha activamente por 20 segundos, seguida de la aplicación del adhesivo y fotopolimerización. En estudios clínicos es posible observar un aumento del manchado marginal del esmalte ya que con el primer ácido no se logra un grabado en esmalte tan efectivo con el primer ácido. Por esta razón, es recomendable el grabado ácido selectivo en esmalte (solamente en esmalte) por 15 a 30 segundos (Cuadro 1 –Figura 4).
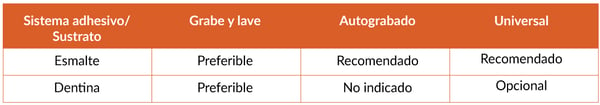
Entre las opciones de sistemas adhesivos disponibles tenemos los sistemas de:
- Grabe y lave: de tres pasos (en que ácido, primer y adhesivo son aplicados en pasos distintos) y de dos pasos (en que el primer paso es la aplicación del ácido y el segundo es la aplicación de una solución única ejerciendo las funciones de primer y adhesivo);
- Autograbado: de dos pasos (en que un primer ácido ejerce las funciones de ácido y primer, seguido de la aplicación del adhesivo) y de paso único (en que una solución única ejerciendo las funciones de ácido, primer y adhesivo es aplicada en el sustrato).
NOTA: Los sistemas adhesivos Universales pueden ser usados en la estrategia “grabe y lave” de 2 pasos o en el autograbado de paso único. Estudios sugieren que la técnica de grabado con ácido selectivo en esmalte para estos sistemas es la ideal 19,20. Después del grabado con ácido fosfórico es indicado el lavado preferentemente con spray aire/agua para una mejor remoción de los detritos después del grabado, tanto del tejido como de los componentes del gel.
Enseguida, el esmalte puede ser secado con chorro de aire, pero se debe mantener una leve humedad en la dentina para evitar el colapso de la trama de fibrilas colágenas expuestas por la desmineralización superficial de la dentina. El nivel de humedad a ser preservado en la dentina depende del tipo de solvente que el sistema adhesivo presente en su composición.
- Gwinnett AJ. Structure and composition of enamel. Oper Dent Suppl 1992;5:10-7.
- Simmer JP, Hu JC. Dental enamel formation and its impact on clinical dentistry. J Dent Educ 2001;65(9):896- 905.
- Silverstone LM. Fissure sealants: laboratory studies. Caries Res 1974;8:2-26.
- Kanca J. Resin Bonding to wet substrate. 1. Bonding to dentin. Quintessence Int 1992;23: 39-41.
- Silverstone LM, Saxton CA, Dogon IL, Fejerskov O. Variation in the pattern of acid etching of human dental enamel examined by scanning electron microscopy. Caries Res 1975;9: 373-87.
- Shaffer SE, Barkeimer WW, Kelsey WP. Effects of reduced acid conditioning time on enamel microleakage. Gen Dent 1987;35:278-80.
- Gilpatrick RO, Ross JA, Simonsen RJ. Resin-to-enamel bond strengths with various etching times. Quintesence Int 1991;22:47-9.
- Pachkam DE. Adhesion. In: Packham DE, Handbook of adhesion. Essex, UK:Longman Scientific & Technical.1992: 18-20.
- Akinmade AO, Nicholson JW. Glass-ionomer cements as adhesives: Part I. Fundamental aspects and their clinical relevance. J Mater Sci Mater Med. 1993;4:95-101.
- Conceição EN e cols. Dentística: Saúde e Estética. 2th ed. Porto Alegre: Artmed, 2007.
- Conceição EN. Dentística: Saúde e Estética. 3rd ed. São Paulo: Quintessence Editora; 2018.
- Kinney JH, Habelitz S, Marshall GW, Marshall SJ. The importance of intrafibrillar mineralization of collagen on the mechanical properties of dentin. J Dent Res 2003;82(12):957-61.
- Linde A, Goldberg M. Dentinogenesis. Critical reviews in oral biology and medicine : an official publication of the American Association of Oral Biologists. 1993;4(5):679-728.
- Barkeimer WW, Shafer SE, Gwinett AJ. Effects of 15 vs 60 second enamel acid conditioning on adhesion and morphology. Oper Dent 1986;11:111-6.
- Soares, PV & Grippo JO. Lesões cervicais não cariosas e hipersensibilidade dentária cervical: etiologia diagnóstico e tratamento. São Paulo: Quintessence Editora;2017.
- Van Meerbeek B, Inokoshi S, Braem M, Lambrechts P Vanherle G. Morphological aspects of the resin-dentin interdiffusion zone with diferente dentin adhesive systems. J Dent Res 1992;71:1530-40.
- Tay FR, Gwinnett AJ, Wei SH, et al. Ultrastructure of the resin-dentin interface following reversible and irreversible rewetting. Am J Dent. 1997;10:77-82.
- Perdigão J. Dentin bonding as function of dentin structure. Dent Clin N Am 2002;46:277-301.
- Tian F, Zhou L, Zhang Z, Niu L, Zhang L, Chen C, et al. Paucity of Nanolayering in Resin-Dentin Interfaces of MDP-based Adhesives. J Dent Res 2016;95:380-7.
- Peumans M, De Munck J, Van Landuyt K, Van Meerbeek B. Thirteen-year randomized controlled clinical trial of a two-step self-etch adhesive in non-carious cervical lesions. Dent Mater 2015;31:308-14.